Золотым стандартом диагностики ФП общепринято считать проведение биопсии печени с последующим гистологическим исследованием. Вместе с тем биопсия печени является инвазивным методом, сопряженным с определенными трудностями, особенно в случаях повторного исследования состояния процесса. Кроме того, оценка степени фиброза с помощью биопсии связана с рядом неблагоприятных событий со стороны больного [3], сложностями отбора пациентов для процедуры и ошибками в ее исполнении [4, 5], различными подходами специалистовгистологов в оценке полученных данных [6].
Однако выявление ФП на ранних стадиях, определение характера его течения играют решающую роль для стратификации диагноза, объема лечения и структурирования представлений о прогнозе хронических болезней печени вне зависимости от их этиологии. И сегодня обсуждать заболевания печени без наличия этих данных так же непрофессионально, как лечить поражения гастродуоденальной зоны без учета инфицирования слизистой оболочки желудка Нelicobacter рylori.
В этой связи все большую востребованность приобретает непрямая ультразвуковая эластография печени, позволяющая с достаточной степенью достоверности верифицировать изменение структуры печени как при первичном обследовании, так и последующем наблюдении. Учитывая ограниченность в нашей стране наличия техники для выполнения этого исследования, украинские врачи нечетко представляют практические возможности метода и его разновидностей. На очередной конфе ренции Украинской ассоциации по изучению заболеваний печени, которая прошла в феврале этого года, были подробно рассмотрены возможности эластографии печени и как значительный прогрессивный шаг вперед было оценено появление в Днепропетровске стационарного цифрового ультразвукового диагностического сканера, позволяющего выполнять эластографию печени в реальном времени.
Согласно цели Украинской ассоциации по изучению заболеваний печени информировать врачей о современных достижениях гепатологии в этой статье нам хотелось бы ознакомить широкую аудиторию врачей с особенностями методик эластографии печени и их значением для клинической практики.
Итак, с начала 2000 г. в распоряжении врачей Западной Европы и США появился метод непрямой ультразвуковой эластографии с использованием аппарата Fibroscan французской фирмы Echosens, именуемый в специальной литературе transient elastography (ТЕ) – транзиторная эластография [7]. Измерение эластичности печени проводится через межреберные промежутки, использующиеся в качестве акустического окна, при помощи специального датчика, который генерирует низкочастотные механические импульсы. Скорость распространения волны сквозь подлежащую ткань печени прямо зависит от ее плотности. Во время одного импульса исследуется примерно 1/500 объема печени, что многократно превышает таковой при пункционной биопсии печени. Среднее значение измерений характеризует эластический модуль печени, результат которого выражается в килопаскалях.
ТЕ проста в исполнении, но не допускает модификаций, так как выполняется слепым методом, без визуализации зоны исследования в В-режиме. Методика узкоспециализирована, т.е. предназначена только для исследования печени. Таким образом, Fibroscan предназначен для решения единственной задачи – определения в количественном эквиваленте плотности ткани печени. Была составлена шкала соответствия абсолютных цифр плотности ткани и цветового спектра. Результат исследования выглядит в виде цифрового отчета.
Согласно общепринятой шкале Metavir проводится следующая морфологическая оценка стадии ФП. Стадия F0 – отсутствие фиброза, F1 – расширение портальных трактов без формирования септ, F2 – портальный фиброз в сочетании с единичными септами, F3 – портальный фиброз в сочетании с множественными септами без ложных долек, F4 – цирроз печени. Показатель плотности ткани печени в килопаскалях при выполнении ТЕ как предиктор начального фиброза коррелирует с уровнями выше F2 шкалы Metavir, но не дает оценки состояния печени соответственно диапазону F1-F2.
На основании полученных данных была предложена следующая схема использования ТЕ для оценки предполагаемого ФП [8]. При показателях ≤6 кПa признаки фиброза отсутствуют, что соответствует F0 и промежуточному уровню F1 шкалы Metavir, биопсия печени не рекомендуется, показано клиническое наблюдение. Значения в диапазоне >6 и ≤12 кПa принимаются как соответствие промежуточному уровню F1-F3 шкалы Metavir, рекомендуется проведение биопсии печени в комбинации с другими неинвазивными методами диагностики, если от результатов зависит тактика ведения пациента. При получении показателей ≥12 кПa состояние больного трактуется как выраженный ФП или ЦП, что соответствует пограничному значению F3 и значению F4, биопсия в такой ситуации не показана. Пациенту проводится скрининг клинических проявлений портальной гипертензии, в частности варикозного расширения вен пищевода, и наличия гепатоцеллюлярного рака.
Предложенная схема использования ТЕ позволила со временем обозначить ряд ограничений и факторов, влияющих на ее точность. Вызывает интерес статья Arena U. et al. (2008), в которой показано, что повреждение печени вследствие острого гепатита с обратимыми изменениями плотности печени при выполнении ТЕ может быть неверно истолковано как ЦП [9]. Сообщается также о другой причине ложноположительных результатов, а именно застое крови в сосудах большого круга кровообращения, в том числе сосудах печени в результате сердечной недостаточности. ТЕ оказалась несовместима с ожирением или асцитом у пациентов на различных стадиях заболевания. Завышение показателей плотности печени, определенных на Fibroscan, установлено при внепеченочном холестазе независимо от степени ФП [10].
Таким образом, на основании многолетнего опыта использования ТЕ сделаны выводы (подробно изложены в докладе на ресурсе www.elsevier.ru/WNH). ТЕ на аппарате Fibroscan, по-видимому, позволяет получить объективную оценку при значительном ФП. При отсутствии такового результаты могут значительно искажаться за счет сопутствующих факторов, а именно воспаления, тканевого отека, холестаза, застойной гиперемии. Результаты ТЕ существенно зависят от индекса массы тела и степени гепатостеатоза. Интерпретация ТЕ на аппарате Fibroscan не может применяться в отрыве от использования допплерографии портальной системы с изучением градиента давления в ее различных отделах.
Экстраполируя диагностические возможности этого метода, большинство зарубежных авторов указывают на адекватные показатели метода в границах F2-F3 по шкале Metavir. ТЕ является хорошо повторяемой методикой, не требует большого опыта от исследователя, не имеет побочных осложнений. Тем не менее существуют проблемы, связанные с воспроизводимостью методики у пациента разными исследователями. Это обусловлено тем, что ТЕ – слепой метод наведения датчика, который не может быть повторен дважды с точным позиционированием эхосигнала в одну и ту же точку интереса [11]. К тому же ТЕ не является методикой реального времени, так как во время проведения диагностики исследователь не получает изображение зоны исследования. Воспроизводимость методики также значительно снижается у пациентов со стеатозом печени и высоким индексом массы тела, так как модальность (чувствительность) ультразвукового исследования сама по себе имеет ограничения у таких пациентов [12]. Вероятно, ТЕ выполнила свое историческое предназначение, явившись отправной точкой в накоплении опыта ультразвуковой эластографии, и дала толчок развитию более совершенных технологий.
Метод неинвазивной оценки плотности ткани печени продолжил свое развитие путем объединения возможности визуализации в серошкальном В-режиме и цветового картирования участков ткани различной плотности. Методика реализована в синхронном выполнении этих режимов: исследователь в В-режиме видит обычную ультразвуковую картину зоны интереса и параллельно в режиме эластографии может оценить плотность этой зоны в режиме цветового картирования. При этом различают два вида эластографии: динамическую, называемую также эластографией сдвиговой волны, и статическую, реализуемую путем простой компрессии датчика.
Эластография сдвиговой волны получила общее название acoustic radiation force impulse (ARFI) – акустическая импульсноволновая эластография [13]. Эта методика сразу же нашла активное применение в оценке плотности глубоко расположенных органов. Принципиальное отличие ТЕ от ARFI заключается в том, что первая методика производится слепым методом с вычислением среднего значения измерений в стандартных точках, что может приводить к ряду артефактов в полученных результатах абсолютной плотности. ARFI лишена этого недостатка, так как определяет искомый показатель в любой конкретно заданной зоне интереса органа. ARFI может быть также применена для исследования эластичности любого другого органа, что расширяет спектр ее использования.
ARFI в последние годы широко освещалась в литературе. Часть работ посвящена сравнению с ТЕ. Так, Sirli R. et al.(2012) сообщают о сравнительной оценке методик ТЕ и ARFI у группы больных с F4, что по шкале Metavir соответствует ЦП [14]. Как преимущества ARFI авторы выделяют возможность, в отличие от методики ТЕ, адекватно оценить состояние портального кровотока и структуру ткани селезенки, особенно на поздних стадиях ЦП, когда риск выполнения биопсии особенно высок. Отмечая различную специфичность и чувствительности методик ТЕ и ARFI, Sporea I.et al. (2011) с целью достижения максимальной диагностической точности предлагают применять их одновременно, что, по мнению авторов, позволит отказаться от биопсии органа [15].
В процессе накопления опыта использования ARFI были найдены дополнительные аргументы в ее пользу по сравнению с ТЕ. Так, Kuroda H. et al.(2012) предложили вариант комбинации ARFI с вычислением специальных показателей аcoustical structure quantification (ASQ) и focal disturbance ratio (FD-ratio) для выявления стеатогепатоза in vivo. По мнению авторов, это значительно повышает диагностический потенциал ARFI у пациентов, у которых наряду с ФП путствуют признаки стеатогепатоза [16].
Безусловным преимуществом ARFI является возможность оценить степень фибротических процессов не только в печеночной ткани, но и в ткани селезенки – как раннего признака развития портальной гипертензии, а также в ткани поджелудочной железы. Между тем проанализированные сегодня данные эластографии селезенки имеют неоднозначное прогностическое значение у пациентов с признаками портальной гипертензии. Rifai K. et al. (2011) оценили возможности ARFI при исследовании плотности селезенки в трех группах пациентов: при хроническом гепатите с и без признаков портальной гипертензии и у здоровых добровольцев [17]. Оказалось, что в норме ткань селезенки более чем в два раза плотнее ткани печени, но при этом уменьшается с возрастом человека. Кроме того, плотность ткани селезенки возрастает с увеличением степени портальной гипертензии, что подтверждено параллельным исследованием с помощью ультразвуковой допплерографии. Кроме того, увеличение плотности ткани селезенки на ранних стадиях портальной гипертензии не коррелирует с изменениями внешних размеров органа. Авторы утверждают, что эластография селезенки менее информативна в оценке ранних стадий портальной гипертензии по сравнению с эластографией печени. Были сделаны попытки оценить информативность и корреляцию показателей, полученных различными способами эластографии для оценки степени ФП. Так, Friedrich Rust M. et al. (2013) указывают, что диагностическая ценность использования ТЕ для оценки фиброза, ARFI правой доли печени, ARFI левой доли печени и фибротеста с коррекцией по гаптоглобину (прямой сывороточный маркер фиброза) у одних и тех же пациентов составили соответственно 17, 24, 40, 7 и 16%. Наибольшая корреляция наблюдалась между показателями, полученными с помощью ТЕ, ARFI правой доли печени и фибротеста с коррекцией по гаптоглобину [18].
Однако ARFI не устраивает исследователей по нескольким причинам. Остается неяным, происходит ли затухание первичного сигнала, излучаемого датчиком и производящего колебание зоны интереса, и насколько этот колебательный импульс однороден и постоянен (его силу измерить не представляется возможным). ARFI, так же как и ТЕ, имеет ограничения применения у пациентов с острыми формами гепатита, при явлениях холестаза и асцита. Тем не менее методика ARFI явилась очевидным эволюционным этапом оценки плотности ткани в абсолютных величинах.
Ряд ведущих фирм – производителей ультразвукового оборудования отдали предпочтение развитию статической эластографии (компрессионной), или, как принято ее обозначать в зарубежной литературе, realtime elastography(RTE) – эластографии в реальном времени. Первоначально RTE получила наибольшее применение при исследовании плотности очаговых изменений в тканях поверхностно расположенных органов (щитовидной железы, молочной железы, предстательной железы, мочевого пузыря, женских половых органов). Это связано с тем, что высокая плотность или жесткость новообразования является показателем его злокачественности. Именно эта особенность неопроцессов была использована для определения степени деформации ткани органа. Мягкие части ткани деформируются в большей степени, а жесткие – в меньшей. Эластографическое исследование в указанных случаях выполняется в реальном режиме времени с совмещенным Врежимом путем последовательной компрессии и декомпрессии поверхностно расположенных органов самим датчиком, который оснащен модулем оценки изменения эластичности зоны исследования. Эта технология измеряет относительный коэффициент жесткости ткани, а также ее цветовой эквивалент в диапазоне от красного (жесткого) до синего (мягкого). Таким образом, показатели RTE являются важным дополнительным критерием оценки характера изменений в тканях различных органов. На практике это позволяет не только с большой вероятностью заподозрить опухолевый или метастатический процесс, но и уточнить область взятия биопсийного материала с целью морфологической верификации.
Относительно новым является применение RTE для исследования эластических свойств глубоко расположенных органов. В настоящее время методика получила широкое распространение в научных центрах США, Японии, Западной Европы. Принцип простой поверхностной компрессии уступил место исследованию плотности глубоко расположенных органов в ответ на пульсационную компрессию любого органа за счет работы сердца и рядом расположенных артериальных сосудов. Так появились методики определения состояния печени, поджелудочной железы и почек. RTE не предоставляет абсолютных результатов плотности органа в килопаскалях, а исследует относительную плотность зоны интереса с участком-эталоном, в качестве которого, как правило, принимается сосуд, расположенный рядом или неизмененная область самого органа. Поэтому методику RTE допустимо назвать сравнительной мультифокусной компрессионной эластографией.
Что касается печени, принцип RTE проиллюстрирован на рисунке 1 с позиции модели пружины. Когда пружина сжата, смещение в каждой точке пружины зависит от жесткости самой пружины.
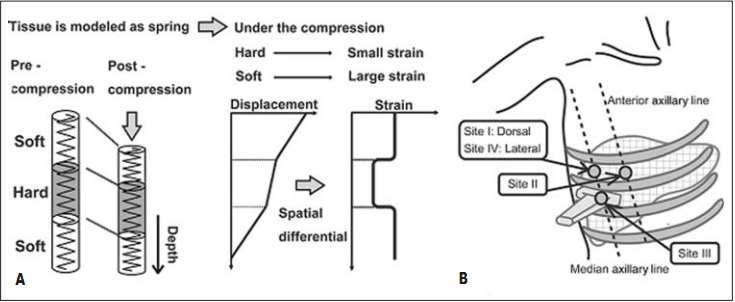
Рис. 1. А – основа метода RTE заключается в анализе и визуализации распределения деформации путем статической компрессии на поверхность тела; это иллюстрируется в виде модели пружины. В – четыре участка приложения компрессии датчиком [19]
Мягкая пружина сжимается больше, чем жесткая. Нагрузка и, в свою очередь, жесткость пружины, измеряются в пространственной дифференциации перемещения в каждой точке. Сначала полагали, что компрессия и декомпрессия ткани с помощью ультразвукового датчика обязательны для исследования плотности ткани. Позже было доказано, что измерять жесткость печени возможно и без добавления какого-либо давления от датчика. Это обусловлено тем, что печень, как и другие внутренние органы, сама по себе подвергается ритмичным компрессионным воздействиям вследствие сократительной работы сердца и передаточной пульсовой волны в крупных артериальных сосудах. Отраженные эхосигналы используются для вычисления перемещения участка ткани печени, и, таким образом, распределения деформации.
В результате сканер отображает цветовую кодировку эластографии, наложенную на Bрежим изображения в реальном времени (рис. 2А). Поскольку цветовая кодировка эластографии показывает только относительную жесткость ткани, для количественного анализа жесткости ткани используется расчетный коэффициент упругости (elastic stran ratio – ЕSR). ЕSR является отношением распределения деформации в двух выбранных областях интереса (region of interest): участка паренхимы печени – ROI (точки I, II, III, IV) и расположенной рядом контрольной точки – ROI (точка V). Для получения значения ЕSR показатель elastic ratio печеночной ткани делится на показатель elastic ratio венозного сосуда. Производится расчет средних значений пяти измерений четырех ESR – между выбранными соответственно четырьмя участками паренхимы печени и точкой контроля.
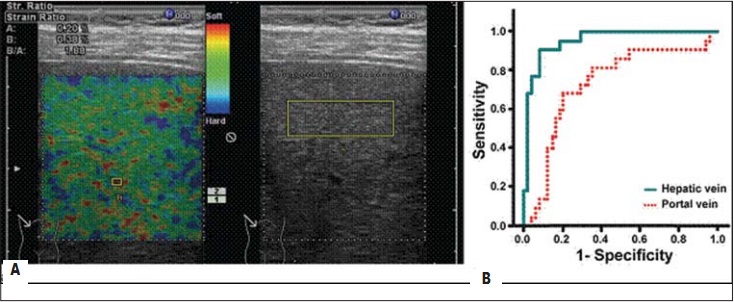
Рис. 2. А – ЕSR вычислен между компрессированной печеночной тканью (правая доля) и сосудом системы печеночных вен. Красный цвет соответствует мягкой ткани, голубой – жесткой. Б – график сравнения специфичности и чувствительности двух точек сравнения. Печеночная вена демонстрирует большую специфичность и чувствительность [19]
ROI паренхимы печени размером 2×1 см устанавливается на расстоянии 1 см от капсулы печени. Ориентиры точек исследования пациента в положении лежа на спине, кроме точки 4 – лежа на боку, были определены в нескольких параллельных работах [17, 19]. Точка 1 располагается в пятом межреберье на пересечении средней подмышечной линии. Точка 2 – в пятом межреберье на пересечении передней подмышечной линии. Точка 3 – в шестом межреберье на пересечении средней подмышечной линии. Точка 4 – в пятом межреберье на пересечении средней подмышечной линии. За контрольную – точка 5 – принимается внутрипеченочный сосуд диаметром не менее 3 мм. ROI контрольной точки устанавливается как можно больше, но, как правило, 0,3×0,5 см.
Были проведены исследования по уточнению, какая из двух венозных структур – печеночная или портальная – является более приемлемой в качестве контрольной точки. Полученные кривые сравнения специфичности и чувствительности обеих контрольных точек (печеночной и портальной вен) представлены на рисунке 2Б. Использование печеночной вены оказалось более специфичным и чувствительным (intraclass correlation coefficient (ICC): 0,953(95% confidence interval (CI): 0,903, 0,998) против 0,731 (95% CI: 0,649, 0,886; р=0,0006). В связи с этим в качестве точки контроля применяются в основном печеночные вены. Референтные значения печеночных вен выбраны еще и потому, что их эластичность не меняется с возрастом. Печеночные вены также не подвержены трансформациям, связанным с повышением или понижением плотности стенки, например при артериосклерозе, и на всем протяжении болезни печени, даже прифибротической трансформации ее паренхимы [19].
Методика RTE занимает 5-7 минут для выполнения всех измерений у пациента на выдохе или вдохе для обеспечения надлежащей визуализации печени. По мнению зарубежных ученых, методика RTE легко воспроизводима, не зависит от ограничений, присущих ТЕ и ARFI, по состоянию пациентов, и что наиболее ценно – показатели RTE имеют четкую корреляцию с морфологическими стадиями шкалы Metavir.
Повышение уровня ЕSR позитивно коррелирует с повышением плотности печени по данным пункционной биопсии (r=0,82, р=0,001) и соотносится с распределением стадий фиброза по шкале Метаvir. Результаты соответствия данных RTE и степени фиброза по шкале Метаvir выглядят следующим образом: F1 – среднее значение 2,21 (диапазон: 1,942,70); F2 – среднее значение 2,69 (диапазон: 2,292,97); F3 – среднее значение 3,42 (диапазон: 3,073,65); и F4 – среднее значение 4,66 (диапазон: 4,404,93). Также цифры, полученные с помощью ЕSR, коррелируют с данными оценки фиброза с помощью исследований показателей гиалуроновой кислоты, коллагена IV типа, APRIиндекса (aspartate aminotransferase-to-platelet ratio index), FibroIndex, лабораторных методик Forns score и Hepascore, соответственно: 0,95, 0,32, 0,73, 0,76, 0,76, 0,87 и 0,70. При этом оценка стадии фиброза F1 методом RTE выявила большую чувствительность по сравнению с серологическим методом [19].
В случае выявления в В-режиме очагового поражения печени врач с помощью RTE оценивает очаг с позиции «доброкачественное/злокачественное образование», проводит предположительную оценку гистоструктуры очага и определяет область биопсии при наличии показаний.
Таким образом, методика RTE дает четкую оценку степени ФП/ЦП согласно шкале Метаvir, принципиально важным является определение ранних стадий заболевания, а также возможность зафиксировать показатель среднего значения ESR mean, изменения которого при последующих исследованиях дают возможность оценить положительную или отрицательную динамику состояния паренхимы печени и эффективность проводимого лечения.
Сегодня уже получен первый опыт применения методики RTE при хронических диффузных заболеваниях печени различного генеза, который планируется осветить в новых публикациях. Подробнее об этом и планах Украинской ассоциации по изучению заболеваний печени можно ознакомиться на сайте www.uasld.org. Мы готовы сотрудничать с гепатологами, гастроэнтерологами, инфекционистами, семейными врачами, которые стремятся получить максимально возможный позитивный результат в лечении этой крайне сложной группы пациентов. Очевидным прогрессом является то, что в арсенале украинских врачей появилась возможность, такая же, как у зарубежных коллег, использовать в повседневной клинической практике инструмент неинвазивной оценки степени ФП.
Литература
1. Friedman S.L. Mechanisms of Hepatic Fibrogenesis // Gastroenterology 2008; 134: 16551669.
2. Северов М.В. Обратимость фиброза и цирроза печени при НСVинфекции. Гепатологический форум 2008, №1, С. 26.
3. Cadranel J.F., Rufat P., Degos F. Practices of liver biopsy in France: results of a prospective nationwide survey. For the Group of Epidemiology of the French Association for the Study of the Liver (AFEF) // Hepatology 2000; 32 (3): 477481.
4. Pagliaro L., Rinaldi F., Craxi A. et al. Percutaneous blind biopsy versus laparoscopy with guided biopsy in diagnosis of cirrhosis: a prospective, randomized trial // Dig Dis Sci 1983; 28 (1): 3943.
5. Regev A., Berho M., Jeffers L.J. et al. Sampling error and intraobserver variation in liver biopsy in patients with chronic HCV infection // Am J Gastroenterol 2002; 97 (10): 26142618.
6. Rousselet M.C., Michalak S., Dupre F. et al. Sources of variability in histological scoring of chronic viral hepatitis // Hepatology 2005; 41 (2): 257264.
7. Sandrin L., Fourquet B., Hasquenoph J.M. et al. Transient elastography: a new noninvasive method for assessment of hepatic fibrosis // Ultrasound Med Biol 2003; 29 (12): 17051713.
8. Vizzutti F., Arena U., Marra F., PinzaniM. Elastography for the noninvasive assessment of liver disease: limitations and future developments // Gut. 2009 Feb; 58 (2):15760.
9. Arena U., Vizzutti F., Abraldes J.G., Corti G., Stasi C., Moscarella S., Milani S., Lorefice E., Petrarca A., Romanelli R.G., Laffi G., Bosch J., Marra F., Pinzani M. Reliability of transient elastography for the diagnosis of advanced fibrosis in chronic hepatitis C // Gut. 2008 Sep; 57 (9): 128893. doi: 10.1136/gut.2008. 149708. Epub 2008 Apr 30.
10. Millonig G., Reimann F.M., Friedrich S., Fonouni H., Mehrabi A., Buchler M.W., Seitz H.K., Mueller S. / Extrahepatic cholestasis increases liver stiffness (FibroScan) irrespective of fibrosis. // Hepatology. 2008 Nov; 48 (5): 171823.
11. Boursier J., Konate A., Gorea G. et al. Reproducibility of liver stiffness measurement by ultrasonographic elastometry // Clin Gastroenterol Hepatol 2008; 6 (11):12631269.
12. Fraquelli M., Rigamonti C., Casazza G. et al. Reproducibility of transient elastography in the evaluation of liver fibrosis in patients with chronic liver disease // Gut 2007; 56 (7): 968973.
13. FriedrichRust M., Ong M.F., Martens S. et al. Performance of transient elastography for the staging of liver fibrosis: a metaanalysis // Gastroenterology 2008; 134(4): 960974.
14. Sirli R., Sporea I., Bota S., Ratiu I. Liver elastography for the diagnosis of portal hypertension in patients with liver cirrhosis. // Med Ultrason. 2012 Sep; 14 (3): 22530.
15. Sporea I., Sirli R., Popescu A., Bota S., Badea R., Lupsor M., Focsa M., Danila M. Is it better to use two elastographic methods for liver fibrosis assessment? // World J Gastroenterol. 2011 Sep 7; 17 (33): 38249. doi: 10.3748/wjg.v17.i33.3824.
16. Kuroda H., Kakisaka K., Kamiyama N., Oikawa T., Onodera M., Sawara K., Oikawa K., Endo R., Takikawa Y., Suzuki K. Noninvasive determination of hepatic steatosis by acoustic structure quantification from ultrasound echo amplitude // World J Gastroenterol. 2012 Aug 7; 18 (29): 388995. doi: 10.3748/wjg.v18.i29.3889.
17. Rifai K., Cornberg J., Bahr M., Mederacke I., Potthoff A., Wedemeyer H., Manns M., Gebel M. ARFI elastography of the spleen is inferior to liver elastography for the detection of portal hypertension // Ultraschall Med. 2011 Dec; 32 Suppl 2: E2430. doi: 10.1055/s00311281771. Epub 2011 Dec 22.
18. FriedrichRust M., Schlueter N., Smaczny C., Eickmeier O., Rosewich M., Feifel K., Herrmann E., Poynard T., Gleiber W., Lais C., Zielen S., Wagner T.O., Zeuzem S., Bojunga J. Noninvasive measurement of liver and pancreas fibrosis in patients with cystic fibrosis. // J Cyst Fibros. 2013 Jan 26. pii:S15691993(13)000064. doi: 10.1016/j.jcf.2012.12.013.
19. FriedrichRustM., Ong M.F., Herrmann E. et al. Realtime elastography for noninvasive assessment of liver fibrosis in chronic viral hepatitis // AJR Am J Roentgenol 2007; 188 (3): 758764.